Tahukah anda apa yang dimaksud dengan energi aktivasi? jawabannya sangat terkait dengan waktu yang dibutuhkan dalam sebuah reaksi kimia. Mari kita bahas selengkapnya dalam artikel berikut.
Pernah nggak, kamu bertanya-tanya, “Sebenarnya apa yang dimaksud dengan energi aktivasi?” kalau lihat eksperimen kimia atau denger soal reaksi kimia? Nah, energi aktivasi ini penting banget buat nentuin apakah reaksi itu bisa cepat atau malah lambat.
Apa yang Dimaksud dengan Energi Aktivasi?
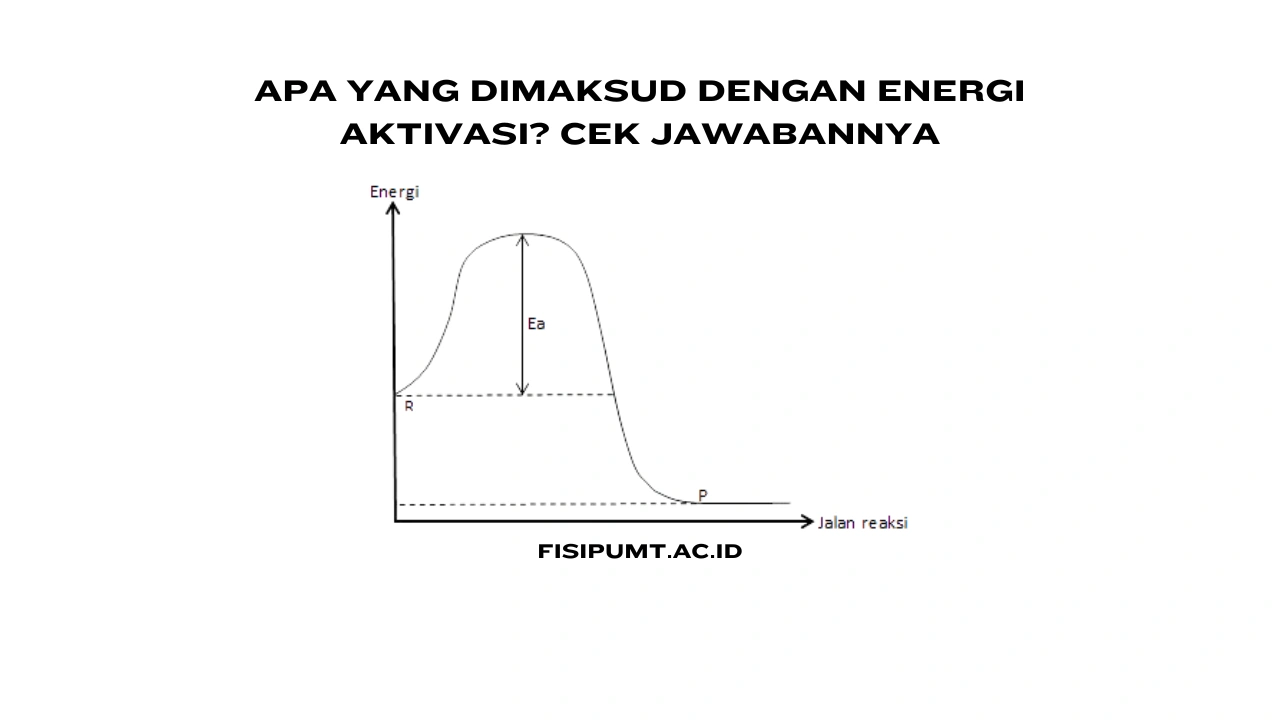
Jadi, energi aktivasi itu kayak tenaga minimum yang diperlukan biar reaksi kimia bisa dimulai. Bayangin kamu lagi dorong bola ke atas bukit, perlu dorongan sampai ke puncak sebelum bolanya nggelinding sendiri ke bawah.
Nah, dorongan yang kamu kasih buat sampai puncak itu bisa diibaratkan kayak energi aktivasi di dunia kimia. Tanpa energi ini, reaksinya bakal stuck, nggak jalan-jalan.
Molekul-molekul yang terlibat di reaksi kimia juga perlu energi buat saling nabrak biar bisa bereaksi.
Faktor-Faktor yang Mempengaruhi Energi Aktivasi
Ada beberapa faktor nih yang bisa bikin energi aktivasi berubah, yuk simak satu-satu:
- Energi Minimum
Energi aktivasi itu energi paling minim yang dibutuhin biar reaksi jalan. Semakin besar energinya, makin susah reaksinya buat terjadi.
Sebaliknya, kalau energinya kecil, reaksi jadi lebih gampang dan cepat.
- Jalur Reaksi
Setiap reaksi punya jalur sendiri yang dilalui molekul-molekulnya. Nah, di jalur ini, ada titik di mana energi aktivasi harus tercapai biar reaksi lanjut.
Beberapa jalur bisa lebih gampang, yang lain bisa lebih susah.
- Pengaruh Katalis
Katalis tuh kayak “booster” reaksi. Dia bisa bikin energi aktivasi jadi lebih rendah, jadi reaksinya bisa jalan lebih cepat tanpa perlu energi yang banyak.
- Kompleks Transisi
Ini adalah saat-saat krusial di mana molekul udah di puncak energi, sebelum mereka berubah jadi produk reaksi. Di fase ini, energi aktivasi lagi tinggi-tingginya.
- Suhu Reaksi
Suhu tuh berpengaruh besar. Semakin tinggi suhu, molekul bergerak lebih cepat dan punya lebih banyak energi buat nyampe energi aktivasi.
Makanya, makin panas, makin cepat reaksinya.
- Kecepatan Reaksi
Energi aktivasi juga ngaruh ke kecepatan reaksi. Kalau energinya rendah, reaksi bakal lebih cepat karena banyak molekul yang bisa nyampe energi yang dibutuhin.
- Energi Kinetik Molekul
Energi kinetik itu energi geraknya molekul. Kalau energinya tinggi, molekul lebih mungkin buat nabrak satu sama lain dengan cukup tenaga buat bikin reaksi jalan.
- Faktor Orientasi Molekul
Selain energi, molekul juga harus punya orientasi yang pas waktu nabrak. Kalau arahnya salah, reaksi bisa nggak terjadi, walaupun energinya udah cukup.
- Hubungan dengan Entalpi
Energi aktivasi juga ada kaitannya dengan entalpi, alias perubahan energi antara reaktan dan produk. Reaksi yang melepaskan atau nyerap energi punya kebutuhan energi aktivasi yang beda-beda.
- Pengaruh Tekanan
Tekanan juga bisa ngaruh, terutama buat gas. Tekanan tinggi bikin molekul lebih sering nabrak, jadi reaksi lebih cepat terjadi karena energinya lebih cepat tercapai.
Kesimpulan
Jadi, energi aktivasi itu energi minimum yang dibutuhin biar reaksi kimia bisa mulai. Banyak faktor yang bisa mempengaruhi energi ini, kayak suhu, katalis, dan tekanan.
Kalau kita ngerti terkait apa yang dimaksud dengan energi aktivasi, kita bisa tau kenapa ada reaksi yang jalan cepat atau lambat.